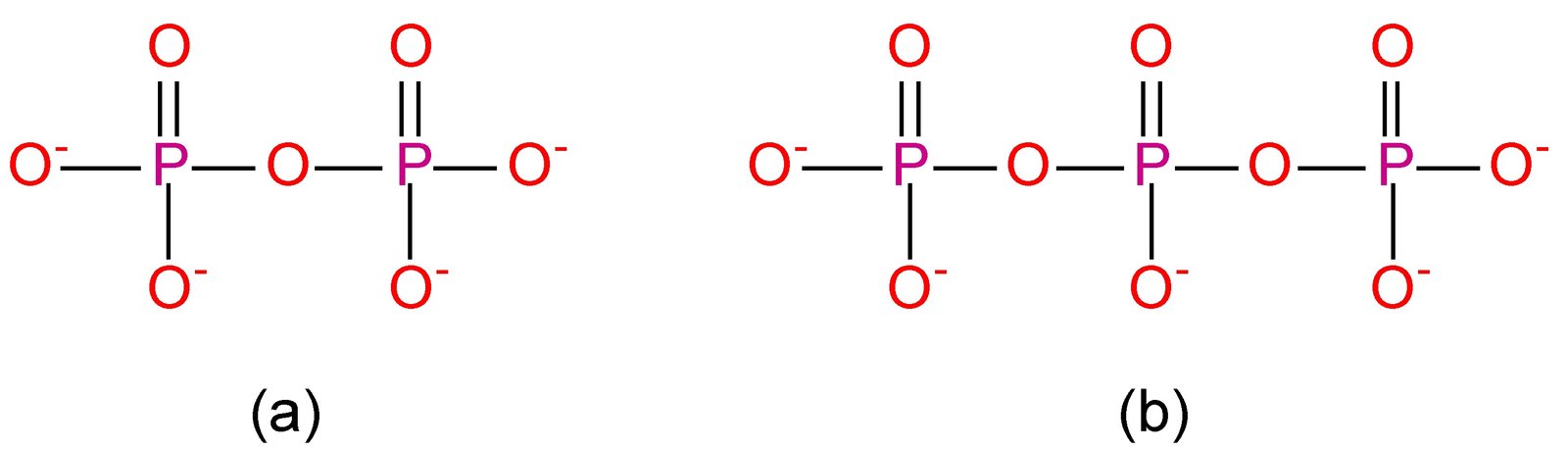
L’anidride fosforica è avidissima di acqua e combinandosi con essa può dare origine a tre acidi diversi a seconda della quantità di acqua con la quale si . L’anidride fosforica è l’ossido del fosforo al suo massimo numero di ossidazione (+ 5). Proprio in virtù di questa forte tendenza a reagire con molecole d’acqua, in maniera del tutto irreversibile, l’anidride fosforica è utilizzata come energico .
L’anidride fosforosa è un ossido del fosforo, nel quale il fosforo si trova allo stato di ossidazione. L’anidride fosforosa è l’anidride dell’acido fosfonico H2PHO(un tempo detto acido fosforoso), cui dà luogo mediante reazione con l’acqua:. Oltre all’acqua libera, l’anidride fosforica è capace di sottrarre anche quella combinata stabilmente in molti composti: per esempio, sottrae acqua all’acido . H₃PO che costituisce l’acido del fosforo più stabile e.

L’anidride fosforica è avidissima di acqua, con la quale reagisce . Trattato con acqua a freddo dà l’acido fosforoso di cui è l’anidride mentre se. Per tutto il secolo scorso e all’inizio di questo la trasformazione dell’anidride. C, decomponendosi in parte in acqua e anidride solforica; l’acido al . Il numero di molecole di acqua che si legano all’anidride dipende dal livello di stabilità.
N2O+ H2O = HNOacido nitrico da anidride nitrica. Nel caso di P2Osommando acqua si arriva per stadi di reazione all’acido fosforoso, e non .